跨细胞运输承担着封闭血-视网膜屏障的意外责任

根据哈佛大学医学院的神经生理学家在小鼠进行的新研究,这种称为转胞增多症的细胞贩运系统实际上可能对控制血液和中枢神经系统之间的屏障渗透性的大部分工作。
3月22日发布的调查结果神经元传统的科学观点认为,细胞之间的紧密连接(就像拉链一样)承担了关闭屏障的责任。
屏障的进化是为了阻止有害物质从血液进入中枢神经系统(大脑、脊髓和视网膜),但它们的选择性也阻止了大多数药物的通过。
这项新研究有助于增强对血脑屏障的基本理解——它在很大程度上是一个黑盒子——是如何形成和发挥作用的,为将来能够操纵它进入药物或对抗某些神经退行性疾病扫清了道路。
“了解障碍作品如何至关重要,如果我们希望能够打开或关闭它以治疗神经疾病,”HMS和研究高级作者神经生物学副教授的副教授表示。“我们开始揭示基本生物学,因此我们可以节省数十亿美元并更有效地提供治疗。”
大多数屏障的研究都集中在紧密连接上。然而,近年来,Gu呼吁人们注意胞吞作用的贡献,在胞吞作用中,选择的分子在称为囊泡的气泡中通过屏障细胞转运。
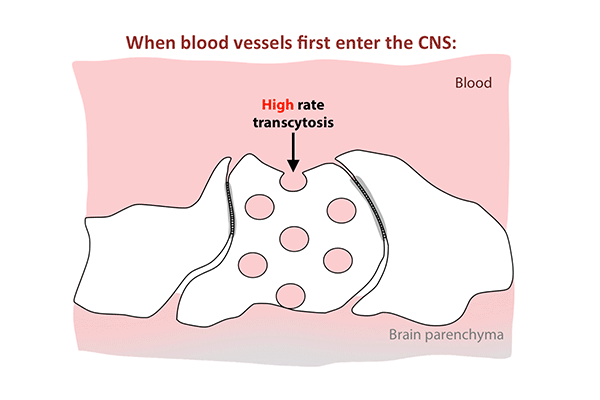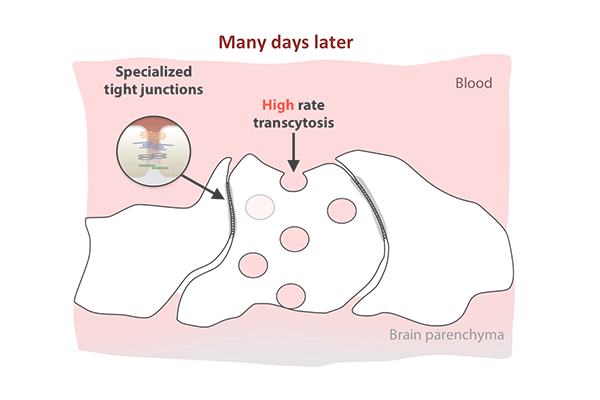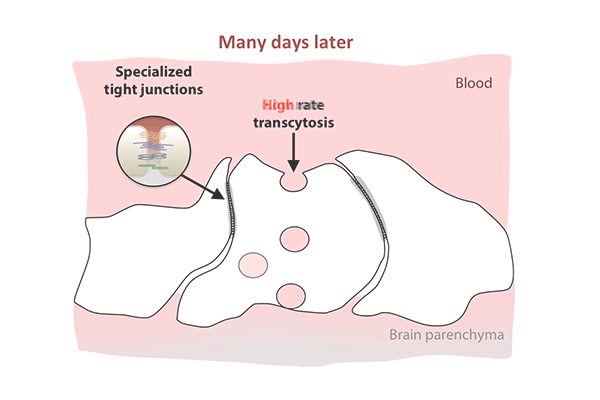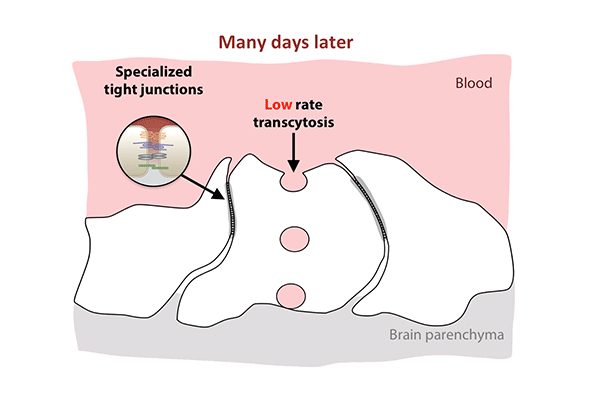
这项新的研究表明,紧密连接在出生时就已经存在于老鼠的视网膜中,当时血-视网膜屏障仍然是可渗透的,而胞吞作用的逐渐抑制解释了屏障最终的封闭。
“当我们看到障碍是如此泄漏的时候,我们认为既有紧张的交叉点和转红枯病也不会形成,”顾说说。“发现紧密的交界处是完全正常的,即使我们进入视网膜令人震惊,甚至对我们来说也会感到震惊,也是如此。”
如果调查结果最终复制在人类中,他们的血脑屏障在出生前表现出来,他们可能会导致新的途径,用于打开屏障,以递送药物或收紧屏障治疗视网膜疾病和某些神经退行性疾病,其中障碍缺陷在神经元死亡之前,包括阿尔茨海默病,als和多发性硬化症。
映射新的领土
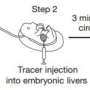
顾世和研究生Brian Chow决定检查血质视网膜屏障,因为它类似于血脑屏障但比较容易研究,因为它是扁平的,像花一样的形状。由于之前没有人在任何生物体中彻底研究过血-视网膜屏障的发育,所以他们从一开始就开始研究了。
每天作为从新生儿到成年人的小鼠,研究人员注入了少量的示踪剂染料,并观察了它是否从血管泄漏到视网膜中,信号传染阻挡者仍然形成,或者是否含有它,表明屏障已经成熟并关闭。
他们观察到,这个屏障在出生时仍然是可渗透的,但在大约10天内,它逐渐从视网膜中心向外封闭。
既然他们使用示踪剂染料,电子显微镜和微小血管微粉切除的组合,在紧密的连接和转胞增多件上检查了障碍闭合,味道和古氏的时间空间地图。
“我们想知道哪一个,紧张的交叉点或抑制转胞增多症,以及他们的相对贡献对障碍是什么,”咸菜说。
流量控制器
尽管紧密连接在第一天就已经被拉上并守卫着屏障,但胞吞作用是另一回事。
在出生后的头几天,屏障细胞充满了小泡,将分子从血液运输到视网膜。到了第八天,交通明显减速。到了第10天,它几乎爬到停止。胞吞作用的下降反映了屏障关闭的模式,从中心向外扩散视网膜。
“我们认为转红菌病是一种途径,我们应该注意,”顾说。“大自然表明它是操纵屏障的好候选人,所以药物可以进入中枢神经系统。”
通过基因改变转红菌率速率,古和杂烩能够加速和延迟障碍物中的屏障闭合。接下来,他们想看看他们是否可以重新打开并关闭障碍在成年老鼠。
进一步探索







.jpg)






用户评论