新技术的目标基因,导致神经退行性疾病
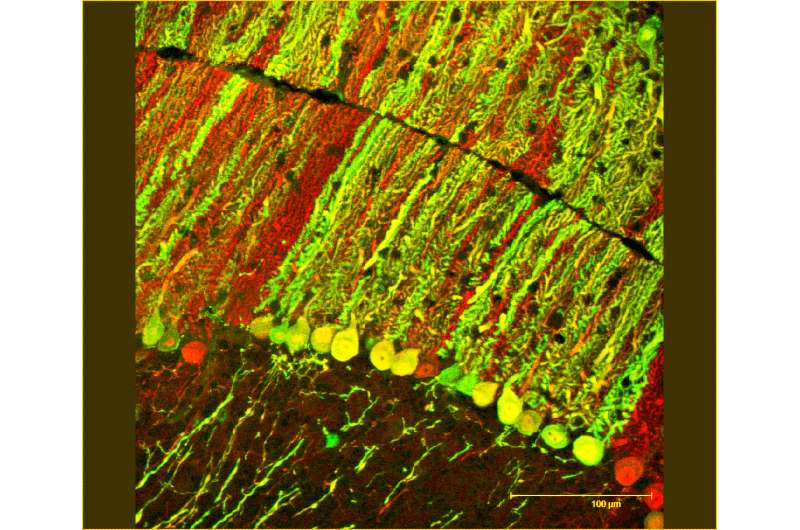
芝加哥大学的神经科学家在研究一个独特的基因表达两种蛋白质,是生命所必需的,另一个,当突变引起神经退行性疾病称为spinocerbellar共济失调型6 (SCA6),已经开发出一种技术来选择性地阻止致病蛋白质而不影响其他。
在一项新的研究中,7月13日发布,2016年科学转化医学,研究人员展示他们能够使用一个修改病毒提供一个小的RNA序列称为微RNA (microrna)阻止突变蛋白的表达和阻止SCA6发展中在老鼠身上。这项技术可能用于治疗其他疾病的突变所引起的所谓“bicistronic”产生多个蛋白质的基因,包括一些形式的癌症。
“我们能够非常手术打击的有毒部分基因和钝锋利的矛,”克里斯托弗·戈麦斯说,医学博士,博士,阿宾娜y Surbis芝加哥大学的神经学教授和这项研究的资深作者。“这是一个技术关闭致病基因可能更少的脱靶效应。”
SCA6是一种遗传性神经退行性疾病,在中年时,使患者慢慢失去肌肉的协调,最终他们的说话能力和立场。人类基因研究确定其作为CACNA1A-a编码基因的突变导致钙通道蛋白的重要神经细胞功能。2013年,戈麦斯和他的团队发现CACNA1A还生产另一个蛋白质,α1ACT,使其成为第一批两个独立的编码基因,人类从一个信使RNA链功能不同的蛋白质。
通常,α1ACT增强脑细胞的生长,但当变异的原因大脑细胞死亡导致SCA6。在疾病的动物模型中,如果研究人员整个CACNA1A基因敲除,动物不活几周,因为他们需要的钙通道蛋白适当发展。
于宫崎骏,医学博士,博士后学者UChicago神经学部门,领导了这项新研究。研究小组能够使用修改后的腺相关病毒,一个小病毒目前还没有引起疾病,提供一个microrna的序列在CACNA1A小鼠致病突变。这阻止了发展SCA6通过阻断α1ACT的表达。
因为SCA6是一种遗传疾病,那么结果就会一天用于筛查和预防。人与一个已知疾病的家族史可以CACNA1A突变筛查和治疗类似的microrna的应用程序。戈麦斯和他的团队也在研究其他交付机制使用分子和已知的药物而不是病毒。
microrna的技术也可以用来治疗其他疾病引起的突变bicistronic基因。虽然只有少数人发现了CACNA1A以来,它们包括乳腺癌和黑色素瘤有关的基因和遗传。
“这使我们能够使用相同的策略与其他分子会抑制其他基因,”戈麦斯说。“它打开更多的门,可以回答我们如何使用它为人类治疗。”
更多信息:“一个miRNA-mediated治疗SCA6块IRES-driven CACNA1A第二顺反子的翻译,“科学转化医学,stm.sciencemag.org/lookup/doi/…scitranslmed.aaf5660