2015年3月31日报告
研究人员发现了生命早期产生的调节性t细胞的重要性
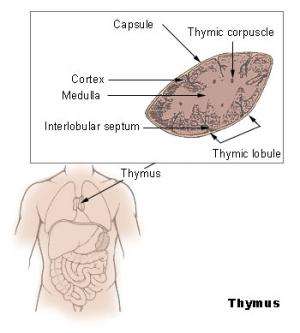
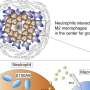
(MedicalXpress) -自身免疫调节蛋白(Aire)起源于胸腺,控制着防止免疫系统攻击身体本身的关键机制。单个T细胞攻击不同的物质;Aire通过产生一系列的mRNA转录本来促进免疫耐受,这些转录本编码人体分化细胞类型的蛋白质特征。来自这些蛋白质的肽显示在胸腺髓质上皮细胞表面的主要组织相容性复合体分子上。
在生命的最初几周,Aire表达可预防APECED(自身免疫性多内分泌病-念珠菌病-外胚层营养不良)个体的自身免疫引起的器官衰竭,这在Aire- ko中观察到(Aire敲除)。老鼠.这种疾病的病理学呈现了一个谜:为什么如此有限的一组组织容易受到自身免疫系统攻击在艾尔不在的情况下?来自波士顿、马萨诸塞州和韩国的研究人员合作进行了一项研究,研究了Aire围产期表达的重要性,以及它在成年小鼠免疫系统中的存在差异。
研究人员首先检查了年轻和年老的Aire- wt和Aire- ko小鼠的胸腺,发现在围产期和成年小鼠中,Aire在胸腺表面表达上皮细胞.表达自身抗原的B细胞失活称为克隆性缺失;在围产期小鼠和成年小鼠中均观察到空气依赖性克隆缺失。
研究人员随后测试了胸腺中t调节因子(Treg)细胞隔室在维持免疫耐受性方面的重要性。他们在出生两天后观察到treg的存在,这些treg在出生4天后发育成大量的种群。这种增长持续了35天。对Treg消融后0 - 10天小鼠的分析显示,Aire-KO小鼠具有多器官自身免疫特征,但对于35- 45天窗口期的小鼠,Treg消融对体重增加或生存没有显著影响。
这一发现的进一步证实使研究人员得出结论,Aire促进了围产期窗口期Treg细胞的生成。然后,研究人员应用诱导Treg谱系示踪系统来建立围产期产生的Treg的表型特性。他们很容易区分成体标记的Treg种群和围壁标记的Treg种群,并发现在示踪剂实验停止后的1到8周内,围壁标记的Treg种群减少到间隔种群的一小部分。
这种持久性使研究人员能够研究围产期生成的treg的功能。他们的发现有力地表明,围产期产生的treg群体表达了持续到成年期的独特功能。在Aire-KO小鼠中引入成年Treg种群并没有改善自身免疫性疾病的症状;相比之下,给有缺陷的小鼠注射围产期产生的treg可显著逆转Aire-KO病理。
研究人员还试图从分子或细胞的角度解释围产期和新生儿Treg区室的差异成年老鼠,发现围产期和成年髓质上皮细胞呈现的肽库不同,成年细胞群似乎更有限。
根据积累的数据,研究人员得出结论,Aire促进特定treg生成的能力解释了它在围产期窗口期的重要性。他们写道:“考虑到我们所记录的抗原处理机制和呈递细胞的年龄依赖性差异,幼年和老年小鼠可能有不同的aire依赖和aire独立的treg。”
此外,胸腺中围生期生成的Treg隔室特别适合保护一组确定的组织免受自身免疫攻击,与受成人Treg活性保护的一组组织几乎没有重叠。研究人员观察到:“这种二分法的一个重要含义是,基于从成年捐赠者分离的treg转移的治疗可能无法影响特定的自身免疫疾病子集。”
更多信息:“生命早期产生的调节性T细胞在维持自我耐受性方面发挥着独特的作用。”科学.DOI: 10.1126 / science.aaa7017
摘要
Aire是一种重要的免疫耐受调节因子,在胸腺基质细胞的一个微小子集中诱导编码肽的转录本,引导t细胞选择。围产期窗口期Aire的表达对于预防Aire缺陷小鼠的多器官自身免疫特征是必要和充分的。我们报道Aire促进围产期Foxp3+CD4+调节性T (Treg)细胞的产生,这种细胞在成年小鼠中稳定存在。该群体在维持自我耐受性、转录组和激活谱方面的作用与成人产生的treg不同。不同的Treg群体在胸腺间质细胞多肽的加工和呈现方面存在年龄依赖和air不依赖的差异,从而导致不同的t细胞受体库。我们的发现扩展了免疫系统发育分层的概念。
©2015 MedicalXpress.com