抑制分子分子的形成可能导致多发性硬化的新治疗方法
多发性硬化症是一种使人衰弱的疾病,它涉及髓鞘的退化——髓鞘是一种脂肪组织,它隔离神经纤维并帮助它们传导脉冲。这一过程被称为脱髓鞘,会导致感觉、运动和思维过程的缺陷,具体取决于受影响的神经纤维。取代失去的髓鞘是治疗多发性硬化和相关疾病的一种有前途的方法,但脱髓鞘和再髓鞘的机制仍不清楚。
Naoyuki Taniguchi和他来自日本理化研究所-马克斯普朗克系统化学生物学联合研究中心的同事们在一项为开发新疗法开辟了一条令人鼓舞的道路的研究中发现,再髓再生被一种叫做支链o -甘露糖聚糖的糖分子所抑制。
Taniguchi及其同事遗传地设计了编码称为N-乙酰葡糖胺基转移酶-IX(GNT-IX)的酶的基因中携带突变的小鼠突变,其催化O-甘露糖基聚糖糖的支化在脑中的蛋白质上。使用这些小鼠,研究人员发现GNT-IX作用于称为受体的特定脑蛋白质蛋白质酪氨酸磷酸酶吗?(RPTP?),此前已被证明在脱髓鞘中发挥关键作用。
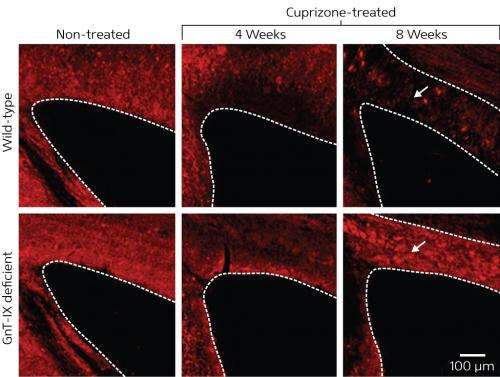
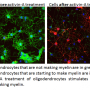
接下来,研究团队喂养正常和突变小鼠的饮食,含有神经毒素的铜序列,通常诱导脱髓鞘。在八周的过程中,发现正常的小鼠已经经历过渐变髓鞘脱失的胼胝体- 连接大脑的两个半球(图1)的白色物质的主要尸体。相比之下,虽然在突变体中骨髓蛋白在突变体中有四周降解了四周,但八周的标记显着增加,表明GNT-IX基因的缺陷增强了重新髓鞘。
进一步的实验表明,铜酮治疗可以激活称为星形胶质细胞的非神经元细胞进入疾病状态,这导致它们表达RPTP?含有支链O-甘露糖基聚合物。在野生型小鼠中,活化的星形胶质细胞表达了这些支链O-甘露糖基聚糖分子,其抑制重新髓鞘。在老鼠然而,有缺陷的GnT-IX基因的星形胶质细胞很少被激活,并且分支o -甘露糖聚糖的缺失允许髓鞘细胞的分化和髓鞘的再生神经纤维在语料库胼callosum。
Taniguchi说:“我们想揭开分支o -甘露糖聚糖激活星形胶质细胞的分子机制。”“了解其潜在机制对于开发治疗药物非常重要多发性硬化症”。
该团队下次计划筛选用于衰减星形胶质细胞激活的GNT-IX抑制剂。“困难的是,药物必须通过血脑屏障,所以与临床医生的合作将重要,”Taniguchi笔记。







用户评论