FDA批准新药用于晚期肺癌
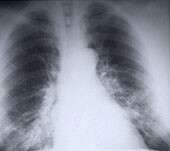
(健康日) - 通过美国食品和药物管理局批准治疗晚期肺癌的新药。
Gilotrif(Afatinib)被批准治疗耐心具有非小细胞的特定亚型肺癌(NSCLC)。大约85%的肺癌是NSCLC,使其成为最常见的肺癌类型。
吉利夫被批准治疗携带关键缺失的肿瘤表皮生长因子受体(EGFR)基因,长期肺癌治疗剂的靶标。FDA表示,据认为,EGFR基因中的突变发生在约10%的非小细胞肺癌中,并且大多数突变由Gilotri靶向。
专家对毒品的批准感到满意。
“该药物代表了10至15%的标准化疗的新重要替代品肺癌患者谁有EGFR突变,“纽约山山肿瘤学项目医疗总监Jorge Gomez博士说。新药物”是为EGFR突变选择的患者开发和批准的第一种药物,“他指出。
Len Horovitz博士是纽约市Lenox Hill医院的肺部专家。他解释说,“肺癌组织的遗传评估已经发展,使得较新的突变可以靶向治疗,”诸如Gilotrif“补体标准化疗的新药,即使在晚期肺癌中也能提高生存率。”
Gilotrif是一类癌症药物酪氨酸激酶抑制剂。这些药物阻断促进癌细胞的发育的蛋白质。
根据FDA,Gilotrif凭借Therascreen EGFR RGQ PCR套件 - 一种伴侣诊断,有助于确定患者是否存在肺癌细胞表达这些EGFR突变。
Gilotrif的批准是基于345名患者的临床研究,随机分配接受Gilotrif或最多六个周期化疗药物Pemetrexed和Cisplatin。接受Gilotrif的患者延迟了肿瘤生长(无进展生存期),比接受化疗的人超过四个月。然而,FDA表示,两组患者在两组患者之间没有统计学上存在显着差异。
随着瘙痒,膀胱炎症,低血钾水平,发热和眼睛炎症等常见副作用,与吉尔替米夫相关的严重副作用包括导致肾衰竭和严重脱水,严重的皮疹,肺炎和肝毒性的腹泻,该机构表示。
戈麦斯表示,FDA批准的速度令人鼓舞。
“AFATINIB的发展和批准显着缩短[比用前肺癌药物观察到],并反映了众所周知的肺癌治疗对最有可能具有重要利益的特定患者的焦点,”他说。“这是一个明确的推动更加个性化的药物。”
FDA药物评估和研究中心血液学和肿瘤产品办公室董事博士博士,同意。
在一个机构声明中,他表示,吉尔托利夫的批准显示了“更加了解疾病的潜在分子途径的更大了解可能导致有针对性治疗的发展。”
5月,FDA批准了Tarceva(Erlotinib)以治疗非小细胞肺癌患者。那药品与COBAS EGFR突变试验相同,鉴定具有EGFR基因突变的肿瘤患者的伴侣诊断。
Gilotrif由康涅狄格州Ridgefield的Boehringer Ingelheim Pharmaceuticals Inc.销售。
进一步探索









用户评论