独立的临床试验,包括在Perelman医学院的Scheie Eye Institute进行的临床试验,已经报告了Leber先天性生物症(LCA)的安全性和疗效,并在循环维生素所需的基因(RPE65)中突变引起的先天性失明一个在视网膜中。遗传性视网膜退行性疾病预先认为是无法治疗和可治区的。在试验中观察到的视力已经提高了改善,但关于固化基因治疗的基因治疗的长期疗效的关键问题仍未得到答复。现在,本周发布了Scheie Eye Institute的新研究国家科学院的诉讼程序发现LCA的基因治疗表明了视力的持久改善,而且还推动受影响的视网膜细胞的退化,无论是相同条件的LCA患者和动物模型。
来自RPE65突变的LCA疾病具有两种组分:生化封锁导致视力受损,并且逐步丧失光敏丧失感光体细胞在受影响的患者的整个生命中。新研究的作者解释说,直到现在,基因治疗已经乐观地假设,但没有被证明,同时解决两种疾病组分。
“我们都希望基因注射治愈两种组分 - 重新建立视力的循环,并防止进一步丧失细胞到第二型疾病成分”临床,铅,临床培训,铅作者和共同调查员。临床在宾夕法尼亚州试验。
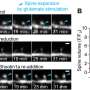
然而,当通过的另外的视网膜细胞层进行测量时光学成像在临床试验中连续多年来,治疗和未经处理的地区的细胞损失率相同。“换句话说,基因治疗改善了视觉,但没有缓慢或停止细胞损失的进展,”Cideciyan评论。
“这些意想不到的观察应该有助于提高目前的治疗,使其更持久,”临床试验的主要调查员MD,博士学位,博士学位评论。“在当前基因治疗试验之前,不同视网膜退化中的细胞损失减缓了大型研究方向。现在,两个方向必须收敛,以确保以这种形式的LCA造成有益视觉效果的寿命。”
在努力调查人员和宾夕法尼亚州兽医学院的兽医学院的长期合作的延续,通过共同作者Gustavo D. Aguirre,VMD,PHD和William A.Beltran,DVM,博士,研究进行了研究测试临床结果是否存在于该LCA的犬模型中,该疾病阶段等于人类患者的疾病阶段。“我们在本犬模型中的基因治疗为患者的临床试验提供了基础,现在我们添加了数据以确认这一事实视网膜变性尽管愿景改进了确实继续“Aguirre。”下一步是执行相关实验,以便询问哪些干预会停止退化(如果添加)基因治疗。“
“这些新调查结果有助于了解LCA的RPE65形式的自然历史和复杂性,为未来调查提供坚定的基础,”眼科和主任部的教授和主席Joan M. o'Brien MD说作者:王莹,SCHEIE EYE学院学报JOURNAL。
信息信息:国家科学院的诉讼程序
由...提供宾夕法尼亚大学医学院