新的监管机制中发现电池系统来消除不需要的蛋白质
一个缺陷基因与一种罕见的血管疾病导致调查人员发现机制参与决定的命运可能成千上万的细胞内蛋白质的工作。
圣裘德儿童研究医院的科学家研究,提供洞察身体的一个最重要的监管体系,泛素系统。细胞用它来消除不需要的蛋白质。问题在这个系统已经与癌症、感染和其他疾病。这项研究发表在今天的杂志的印刷版分子细胞。
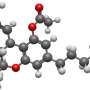
研究人员演示了如何一种蛋白质命名Glomulin绑定到一个关键组成部分监管体系。调查显示,不仅Glomulin结合位点也绑定如何关闭不必要的标签蛋白的生化级联拆除。
未来研究发现强调潜在的新方法旨在发展glomuvenous畸形的治疗方法,这与基因突变使Glomulin蛋白质。畸形,通常出现在出生,导致静脉引起变色引起皮肤肿块,有时是痛苦的,毁容。
“调查结果显示它可能有一天有可能关闭缺陷所造成的治疗疾病蛋白质泛素系统通过找到一个替代的机制将途径。Glomulin方式代表了一种新的控制方式的一个最重要的监管体系在细胞。我们相信Glomulin可能代表了冰山的一角。可能有很多蛋白质,以这种方式工作,”布伦达·舒尔曼博士说,圣裘德部门的一员结构生物学和霍华德·休斯医学研究所研究员。她是这项研究的高级通讯作者。
细胞依赖这种蛋白质泛素系统来保持平衡。蛋白质泛素化过程的一部分,一个小从一个酶传递到下一个像接力棒接力赛,直到达到一种蛋白质复杂的称为cullin环连接酶。那里,等待小蛋白质转移到靶蛋白,标志着毁灭。
在这项研究中,研究人员表明,Glomulin扰乱了泛素化通过“牵绊”到和掩蔽现货cullin环连接酶标记过程完成。结合位点在RBX1蛋白质,cullin环连接酶的一个组成部分。Glomulin它的名字来自疾病的时候,研究人员表明,名字也恰当地描述Glomulin的分子功能。
早些时候的研究建立在实验室的詹姆斯DeCaprio工作,医学博士波士顿丹娜-法伯癌症研究所的。DeCaprio,这项研究的合著者,和他的同事报道,Glomulin调节cullin环连接通过绑定到RBX1蛋白质。他们还报道,Glomulin不绑定到相关RBX2蛋白质。
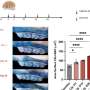
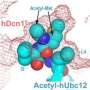
圣裘德在这项最新研究中,科学家利用x射线晶体学来确定结构参与Glomulin的交互与RBX1 cullin环连接酶的另一个组件。“这是一个“啊哈”的时刻,”舒尔曼说。“看到结构几乎立即告诉我们如何Glomulin扰乱了泛素化过程。”
额外的测试表明,Glomulin RBX1表面蛋白质结合紧密。绑定可以防止酶带着死亡之吻蛋白标记交付货物。结构还建议如何Glomulin突变与glomuvenous畸形RBX1防止蛋白质绑定。
研究人员表明,Glomulin扰乱了泛素化通过绑定到同一地点在cullin环连接酶酶带着泛素蛋白必须绑定到完成的过程。RBX1蛋白质上的位置,这是更大的蛋白质复合体的一部分。
“RBX1调节可能数千个不同的蛋白质在细胞内。Glomulin代表一种新的方式来调节整个类RBX1相关蛋白质,”科学家大卫·杜达博士说。舒尔曼的实验室和研究的第一作者。Glomulin是第一蛋白质由一个细胞显示RBX1阻止类似的网站。