一个病毒如何使用模拟程序成功复制
病毒和癌症都破坏细胞内的生长控制机制以满足自身的需要。根据一项新的研究,至少有一种病毒通过模仿来获得这种机制。
两者的常见目标是称为视网膜母细胞瘤蛋白的细胞蛋白,或PRB,其用于阻止在存在潜在的癌症的基因突变时阻断细胞分裂。首先在视网膜的儿科肿瘤中鉴定出来,这种肿瘤抑制蛋白已被发现在破坏时在许多其他形式的癌症中起作用。
许多病毒产生特异性靶向PRB的蛋白质,科学家们已经研究了这些病毒及其蛋白质,以更好地了解如何癌细胞变化。在这些病毒中是腺病毒,其产生称为E1A的蛋白质,干扰PRB及其控制不需要的细胞分裂的能力。腺病毒不是自己的癌症导致,而是更好地了解他们如何与PRB互动的互动可能很好地阐明了其他病毒使用的相关机制来触发癌症。例如,一种与人乳头瘤病毒的e1a有效的蛋白质,称为E7,导致宫颈癌在它感染的细胞中。
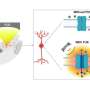
到目前为止,研究人员还无法获得关于E1A如何破坏pRb正常功能的详细信息。然而,一项新的研究刊登在了11月1日的杂志封面上基因与发展,Wistar学院的研究人员已经解决了PRB和E1A的分子复合物的三维结构,提供了病毒E1A蛋白的第一个原子视图。
结果表明,E1A以新颖的方式操作,模仿称为E2F的正常细胞蛋白,通常以受控和调节的方式结合PRB。
“E1A和E2F之间的结构相似性令人惊讶和引人注目,”Wistar和Rear Author关于该研究的高级作者的基因表达和监管计划教授博士说。“看着这种结构变得明显,这种病毒蛋白如何破坏PRB的活动。”
pRb是“口袋蛋白家族”的一员,因为它有一个可以结合蛋白质的口袋。为了使pRb正常发挥作用,它需要结合一个包含E2F蛋白的分子复合物。当pRb结合到这个复合体时,它作为生长抑制剂,抑制细胞分裂。
在他们的研究中,Marmorstein和一位同事们表明E1A通过模拟E2F和占据同样的口袋来控制细胞分裂的PRB及其控制细胞分裂的能力,其中E2F通常会结合。
“看着结构,我们看到E1A蛋白通过与PRB的特定位置结合,”Marmorstein说。“通过以这种方式敲掉PRB,E1A强迫细胞开始不受控制地分开癌症的标志。”
他补充说,这种靶向pRb的方法与其他病毒蛋白质使用的方法非常不同。
该研究提供了关于E1A蛋白的第一结构信息。在开发用于结构测定的所需晶体时,Xin Liu是该研究的牵头作者,首先必须鉴定蛋白质合适的结合伴侣。
“因为E1A是如此灵活,它需要将绑定伙伴结晶,”刘说。
通过与PRB和这些结合伴侣形成复合物,研究人员能够将蛋白质结晶,然后使用称为X射线晶体学的技术分析其结构。他们的研究揭示了复合体的每个部件如何以三维细节工作。
科学家们正在努力分析与PRB和其他细胞E1A靶向的E1A蛋白的较大区域的结构更充分地表征该病毒机制如何引起癌症。
来源:Wistar Institute






用户评论