研究人员发现改善胰腺癌治疗的特征
来自加州大学欧文分校、密歇根大学和德克萨斯大学MD安德森癌症中心的科学家们为胰腺癌研究领域做出了重大贡献。他们的新研究提出了胰腺癌生物学中的几个关键主题,这些主题可以作为胰腺癌治疗的标志。这些主题包括基因组改变、代谢、肿瘤微环境、免疫治疗和创新的临床试验设计。这项研究发表在杂志上细胞。
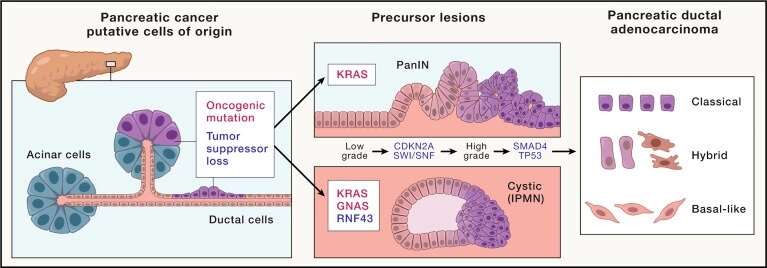
胰腺导管腺癌它代表了绝大多数胰腺癌,是胰腺癌中最具挑战性和最致命的形式之一癌症。尽管在过去的几十年里,对PDAC生物学的理解取得了实质性的进展,但对大多数患者的临床护理并没有看到重大突破。然而,作者认为,他们定义为标志的这些领域的综合进展将证明对这种疾病的治疗具有变革性。
UCI分子生物学和生物化学助理教授、主要作者克里斯托弗·哈尔布鲁克(Christopher Halbrook)说:“最初针对PDAC的努力大大简化了疾病的复杂性。我们经历了几十年的艰苦工作,在了解胰腺肿瘤复杂性的技术突破的帮助下,最终为我们的患者提供了更好的治疗方法。”
作者强调了从多个角度治疗这种疾病的重要性,包括尽可能多的特征,以获得最大的成功机会。
他们的综述总结了已经出现的支持遗传发育和胰腺肿瘤发生的路径进展的共识模型。它进一步强调了几个令人兴奋的正在进行的研究的例子,包括开发研究性化合物和临床部署的方法,以靶向PDAC的遗传和免疫特征,癌症代谢和耐药。
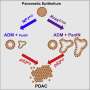
作者还讨论了单细胞分析和高维空间分析技术的进步如何揭示了细胞群在胰腺肿瘤内动态相互作用的多样性,并讨论了如何开始破坏这些网络以提高对治疗的反应。这些方法将与令人兴奋的新治疗发展途径相结合,如癌症疫苗和药物抗体药物配合这对未来的胰腺癌治疗具有巨大的潜力。
作者还表达了他们对胰腺癌研究和治疗未来的乐观态度。
“在过去的10年里,PDAC的5年生存率已经翻了一番,而此前几十年一直停滞不前。我们相信,科学界的集体努力将继续这一趋势,将PDAC从一种难以控制的疾病转变为一种可控制的疾病,”Halbrook说。
作者希望他们的发现能激发进一步的研究,并最终改善治疗方法和结果胰腺癌病人。
这项工作包括与密歇根大学的Costas Lyssiotis和Marina Pasca di Magliano以及德克萨斯大学MD Anderson癌症中心的Anirban Maitra合作。
更多信息:Christopher J. Halbrook等人,胰腺癌:进展与挑战,细胞(2023)。DOI: 10.1016 / j.cell.2023.02.014