科学家发现潜在的对肺癌的诊断和治疗目标
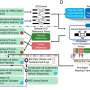
中国科学家最近报道所发挥的关键作用在肿瘤生存histone-acetylation-regulated长非编码RNA称为溶酶体的细胞死亡调节器(LCDR),提供了潜在的对肺癌的诊断和治疗目标。
高山教授为首的苏州生物医学工程技术研究所中国科学院(CAS),研究人员发现LCDR击倒的肺癌细胞可以促进细胞凋亡。研究结果发表在PNAS。
溶酶体是参与细胞内稳态,其失调与各种人类疾病,包括癌症。LncRNAs与长度超过200个核苷酸的非编码rna,失调与癌症有关的标志。他们开车癌症生长和存活的相互作用DNA, RNA和蛋白质组装,包括异构核糖核酸蛋白(hnRNP)的家庭。
然而,lncRNAs和/或hnRNPs是否参与lysosome-mediated癌症生存尚未阐明。
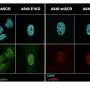
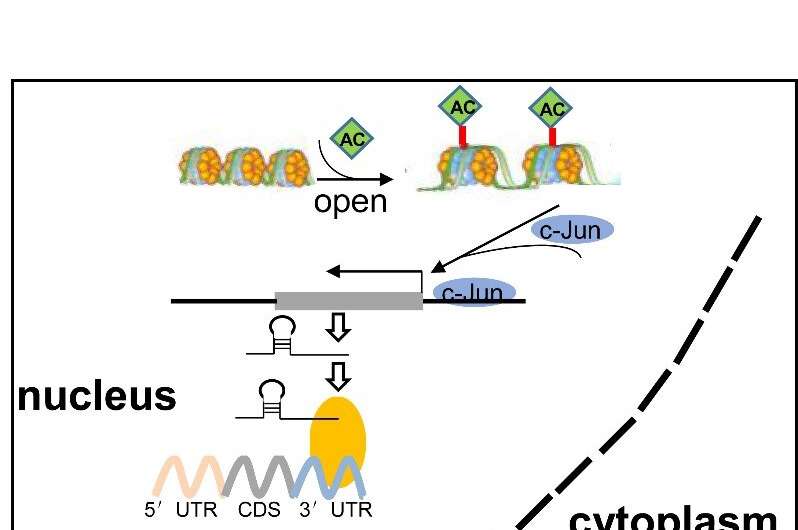
在这项研究中,LCDR异构核核糖核蛋白结合K (hnRNP K)调节的稳定性lysosomal-associated蛋白质跨膜5 (LAPTM5)记录,维护溶酶体膜的完整性。
据研究人员介绍,LCDR击倒,hnRNP K或LAPTM5提升溶酶体膜透化作用和溶酶体的细胞死亡,从而导致细胞凋亡。LAPTM5过度或组织蛋白酶B在溶酶体抑制剂部分恢复这个轴的影响细胞死亡在体外和体内。
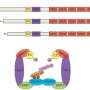
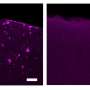
同样,针对LCDR显著降低肿瘤生长patient-derived的异种移植肺腺癌(LUAD)和使用纳米颗粒导致显著的细胞死亡(NPs)介导系统核交付。
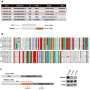
此外,LCDR / hnRNP K / LAPTM5调节LUAD组织,和他们co-expression显示增加了LUAD诊断价值。
这些发现揭示LCDR hnRNP K / LAPTM5作为潜在的治疗目标,表明溶酶体在癌症治疗是一种很有前途的战略目标。
更多信息:LCDR问:0调节溶酶体膜的完整性hnRNP K-stabilized成绩单和促进细胞存活,美国国家科学院院刊》上(2022)。DOI: 10.1073 / pnas.2110428119。