心脏病发作后,心脏是如何向骨髓细胞发送求救信号的

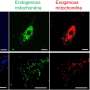
人类细胞脱落外泌体。这些微小的细胞外膜结合囊泡可以携带不同负荷的蛋白质、脂质或核酸进行细胞间通信。
阿拉巴马大学伯明翰分校和中国研究人员现在报告说,外泌体是心肌在心脏病发作后发出SOS信号的关键。心脏病发作后,血液中的外泌体携带大量的心脏特异性micrornas -在小鼠和人类中都有观察到。这些外泌体优先携带microrna到祖细胞细胞在骨骨髓。在这些祖细胞内,microrna会关闭一个特定的基因,该基因允许祖细胞离开骨髓,进入血液。然后这些细胞前往心脏试图修复。
研究人员说,这种新途径的发现——修复性骨髓细胞从受损心脏到全身反应的信号——现在可以用于改善心脏病发作后基于细胞的心血管修复。
这项研究由UAB生物医学工程系教授、分子心脏病学项目主任秦刚建博士和中国武汉华中科技大学医学博士程敏博士领导,发表在该杂志上自然通讯.
15年来,人们一直知道,心脏病发作后,骨髓会释放出祖细胞。这些细胞移动到受损的心肌试图修复。然而,许多改善这种修复的努力充其量只产生了有限的效果。
同样,十几年来,人们已经知道,在动物和人类急性心脏病发作后,心肌中丰富的少量microrna在血液中大幅升高。
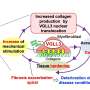
UAB和中国的研究人员现在已经将这两个观察结果联系起来,他们确定了运送这些心肌microRNA的载体,确定了载体的首选目的地,并描述了从骨髓中释放祖细胞的microRNA机制。
研究细节
研究人员发现,在小鼠模型心脏病发作后,心脏病发作后外周血中四种心肌特异性micrornas (myo- mir)的水平升高了1万至10万倍。这些myo-miRs优先被骨髓单核细胞吸收,在较小程度上,被肾细胞吸收。MicroRNAs,或称miRNAs,是一种可以调节基因表达的小的非编码rna。人类基因组似乎可以制造至少2000种不同的mirna。
结果发现,在心脏病发作后,血液中的外泌体绝大多数携带了三种myo- mir -1a, miR-208a和miR-499-5p。第四个myo-miR miR-133a部分由外泌体携带。值得注意的是,在被称为急性st段抬高心肌梗死的严重心脏病发作后,在人类中也可以看到循环外泌体myo-miRs的显著增加。
来自非心脏病发作小鼠的外泌体不携带myo- mir。研究人员发现,心肌梗死后产生的myo-miR外泌体和非心肌梗死外泌体都很容易转移到骨髓单个核细胞中。
众所周知,趋化因子受体CXCR4的阻断介导动员骨髓祖细胞进入血液循环,并有助于修复心肌后的心攻击.由于其中一种myo- mir显示出与CXCR4 mRNA的潜在结合,所有四种myo- mir都在骨髓单个核细胞上进行了测试。令人惊讶的是,每个myo-miR单独都能下调CXCR4的表达。此外,来自心脏病发作小鼠的外泌体(而非非心脏病发作小鼠的外泌体)下调了骨髓单个核细胞中的CXCR4。
最后,研究人员表明,外泌体来自心脏病发作小鼠,当转移到完整小鼠时,骨髓中CXCR4的表达显著降低单核细胞并引起骨髓外祖细胞的动员。因此,总的来说,受伤的心脏发出了动员骨髓祖细胞的信号。
“我们的研究表明,缺血心脏释放的外泌体实际上起着中介作用
骨髓祖细胞对损伤部位的全身反应,”研究人员报告说。“这些观察结果是令人信服的,因为循环myo- mir不仅是一种生物标志物,而且是缺血性心脏和远程骨髓器官之间复杂对话的功能组成部分。”
因为的关键作用骨髓祖细胞“在缺血组织修复中,”他们说,“这项研究中确定的机制可能是缺血损伤生理反应的重要组成部分,因此可以用于缺血的治疗。心疾病。
更多信息:闵成等。来自梗死心脏的循环心肌microrna在外泌体中携带,并动员骨髓祖细胞,自然通讯(2019)。DOI: 10.1038 / s41467 - 019 - 08895 - 7