FDA允许销售制造动静脉瘘的设备
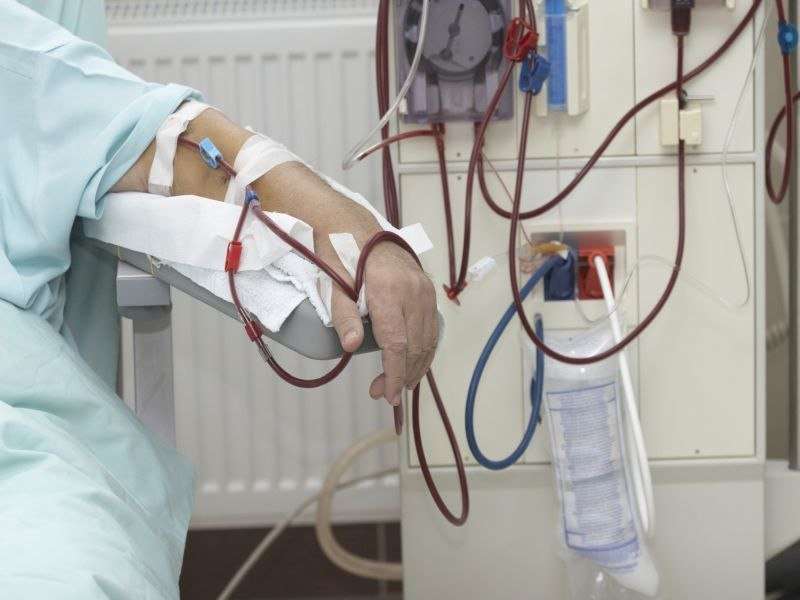
美国食品和药物管理局已批准两种基于导管的设备上市,这两种设备旨在为需要血液透析的慢性肾病患者制造动静脉(AV)瘘。
该装置设计用于经皮造瘘管;术前需造房室瘘管病人可以开始血液透析。将导管插入手臂的血管并引导到计划瘘管的位置。ellippsys血管通路系统和everlinQ endoAVF系统分别使用1根导管和2根导管。
对于ellippsys血管通路系统,FDA审查了一项涉及103例患者的研究数据。手术后三个月,89.3%的患者符合可用的房室瘘管的标准。为了维持瘘管,几乎所有患者(96.1%)在头12个月需要额外的手术。对于everlinQ endoAVF系统,FDA在一项多中心研究中审查了60名患者的数据,以及其他研究的数据。在主要研究中,86.7%的患者在手术后3个月内符合可用的AV瘘管的标准。总的来说,96.7%的患者需要额外的治疗过程在瘘管形成的时候。
FDA设备和放射健康中心心血管设备部主任Bram Zuckerman医学博士在一份声明中说:“今天的行动将为需要血液透析的患者提供额外的、低侵入性的血管通路选择。”
进一步探索
版权©2018每日健康。保留所有权利。













用户评论