人类肥胖代谢潜在总开关
肥胖是21世纪最大的公共卫生挑战。肥胖影响了全世界超过5亿人,花费至少2000亿美元每年仅在美国,并有助于可能致命的疾病,如心血管疾病、2型糖尿病和癌症。
但现在可能是一个新的方法来预防甚至治疗肥胖,多亏了一项研究由麻省理工学院和哈佛医学院的研究人员和今天的发表新英格兰医学杂志》上。通过分析细胞电路基础最强的基因与肥胖协会研究人员发布了一个新的途径,控制人体新陈代谢,促使我们的脂肪细胞储存脂肪或脂肪细胞,或烧掉它。
“肥胖一直被看作是失衡的结果我们所吃的食物和我们练习,但是,这种观点忽略了遗传学的贡献每个人的新陈代谢,”资深作者Manolis凯利斯说,教授计算机科学和一名麻省理工学院计算机科学和人工智能实验室(CSAIL)和广泛的研究所。
新的机制发现
最严重的肥胖驻留在一个基因区域被称为“FTO,”自发现以来一直密切关注的焦点是在2007年。然而,先前的研究未能找到一种机制来解释遗传差异在该地区导致肥胖。
“许多研究试图链接FTO地区的大脑回路控制食欲或运动倾向,”第一作者说美琳娜Claussnitzer,做成客座教授和讲师医学贝斯以色列女执事医疗中心和哈佛医学院。“我们的研究结果表明,肥胖相关地区的行为主要在脂肪细胞祖细胞brain-independent。”
认识到肥胖相关地区可能的细胞类型,研究人员使用注释的基因控制开关100多个组织和细胞类型。他们发现的证据主要控制交换机在人类脂肪细胞的祖细胞,这表明遗传差异可能影响人类脂肪储存的功能。
研究在脂肪细胞基因差异的影响,研究人员聚集脂肪样本健康欧洲人携带危险或没有什么版本的地区。他们发现风险版本激活脂肪细胞的祖细胞的主要控制区域,打开两个遥远的基因,IRX3 IRX5。
生热作用的控制
后续实验表明,IRX3和IRX5充当主控制器的过程称为生热作用,即脂肪细胞能量消散热量,而不是储存为脂肪。生热作用可以由运动、饮食、或暴露在冷,和发生在mitochondria-rich棕色脂肪细胞发育相关的肌肉,和米色脂肪细胞,而不是与储能白色脂肪细胞。
“早生热作用的研究主要集中在棕色脂肪,在小鼠中起着重要作用,但在成人几乎是不存在的,“Claussnitzer说。”这个新通路控制的生热作用更丰富的白色脂肪存储相反,及其基因与肥胖协会表示它会影响全球人类能量平衡。”
研究人员预测,基因的差异只有一个核苷酸肥胖协会负责。在个体风险,胸腺嘧啶(T)是胞嘧啶(C) nucleobase所取代,从而打乱镇压控制区域,打开IRX3 IRX5。然后关闭生热作用,导致脂质积累并最终肥胖。
通过编辑单个核苷酸位置使用CRISPR / Cas9系统技术,这种技术可以让研究人员对DNA序列,研究人员可以进行精确的更改精益和肥胖的签名在人类pre-adipocytes之间切换。切换C T风险个人关闭IRX3 IRX5,恢复生热作用的没有水平,并切断脂基因。
“知道背后的因果变异肥胖协会允许体细胞基因组编辑作为个人携带风险等位基因的治疗途径,”凯利斯说。”,但更重要的是,发现细胞电路可能允许我们拨代谢风险和没有什么个人总开关,作为一种手段来应对环境、生活方式,或遗传因素肥胖。”
在人类和小鼠细胞的成功
研究人员表明,他们的确可能操纵这个新途径逆转肥胖的签名在人类细胞和老鼠。
主要从风险或脂肪细胞的没有人,改变的表达IRX3或IRX5储能白色脂肪细胞功能和燃烧能量的米色脂肪细胞之间的切换功能。
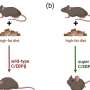
同样,镇压IRX3在小鼠脂肪细胞在全身能量平衡导致了戏剧性的变化,导致减少体重和所有主要的脂肪储存,并完成抗高脂肪饮食。
“通过操纵这个新途径,我们可以切换储能和能量耗散的项目同时在细胞和有机体的水平,为治疗提供新的希望与肥胖,”凯利斯说。
研究人员目前在学术界和产业界建立协作翻译他们的发现肥胖疗法。他们也使用他们的方法作为模型来理解其他疾病有关的区域的电路在人类基因组中。
进一步探索