阿尔茨海默氏症蛋白的结构可以解释其毒性
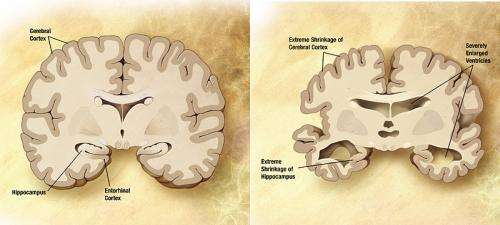
芝加哥伊利诺伊大学的研究人员确定了脑斑块的细纤维中一种蛋白质的分子结构,这是阿尔茨海默氏病的标志。该分子称为淀粉样β-42,对神经细胞有毒,据信会引起该疾病的级联反应。
该研究在日记中在线自然结构和分子生物学。
知道42个氨基酸长的形式的物理结构淀粉样蛋白βUIC化学教授兼研究首席研究员Yoshitaka Ishii说,在纤维中是理解它如何折叠不当并聚集成有毒斑块的关键。
Ishii和他的同事们发现,淀粉样蛋白原纤维中的淀粉样蛋白β-42形成了三个平坦的结构(称为β片),这些结构在“ S”模式中互相旋转。他们还发现,蛋白质上的最终氨基酸在S的第一回合中形成带有氨基酸的“盐桥”,从而稳定结构。盐桥是阳性和负分子或分子部分之间的键。
3-D结构与淀粉样蛋白β-40的结构明显不同,淀粉样蛋白β-40的结构在化学上相似,更丰富的蛋白质也与阿尔茨海默氏症有关。淀粉样蛋白β-40缺少最终氨基酸,该氨基酸带有形成盐桥所需的负电荷。
Ishii说:“这解释了为什么淀粉样蛋白β-42不与淀粉样β-40相互作用,或者将其募集到对神经细胞有毒的斑块中。”
淀粉样蛋白β-42的结构特征和折叠行为为阿尔茨海默氏病以及其他神经退行性疾病的淀粉样蛋白传播提供了新的观点。他说,旨在反对淀粉样β-40的药物,“可能对更毒性淀粉样蛋白β-42效果不佳。”
Ishii说,淀粉样β-42的化学性质(尤其是其对水的极端厌恶)对化学家和结构生物学家提出了巨大的挑战。“有许多实验室一直在研究这个问题,我为我的研究生Yiling Xiao的工作感到自豪,以阐明其结构。”Xiao是研究的第一作者。
进一步探索