研究揭示了世界上第一个淀粉样疾病的药物是如何工作的
来自斯克里普斯研究所的科学家和辉瑞公司发表了一项新的研究显示一种新药叫tafamidis (Vyndaqel)工作。Tafamidis,批准使用在欧洲,目前正在审查由美国食品和药物管理局(FDA),是第一个批准的药物治疗淀粉样疾病的主要监管机构,一类条件,包括阿尔茨海默氏症。
Tafamidis对待转体基因引起的一种致命的神经疾病(竞技场队伍)淀粉样原纤维形成,或异常的程序集的竞技场队伍蛋白的积累。药物抑制聚合,竞技场队伍和临床试验表明,它延迟神经破坏的典型发展多神经病患者。
“细节在这篇文章中,结合临床试验数据,显示一个第一次淀粉样疾病可以成功治疗通过减少淀粉样蛋白的生成速率,”部门的主席杰弗瑞·w·凯利说,分子和实验医学海森、利安嫩伯格教授化学,Skaggs研究所的成员化学生物学斯克里普斯研究。凯利是一个新文章的资深作者,在一种进步,在线早期版本的问题美国国家科学院院刊》上2012年5月29日。
一批进步的症状
而自然发生或“野生型”转体基因蛋白是导致老年人容易聚合引起心脏疾病,各种不稳定的突变导致原发性心肌病或早发性多神经病的形式,称为家族性淀粉样多神经病竞技场队伍,影响全世界约10000人。
家族性淀粉样多神经病妥协外围和自主神经系统症状包括感官剥夺和疼痛,肌肉无力和浪费,交替便秘和腹泻。在某些家族性淀粉样多神经病患者,心肌病可以出现后的疾病。
在转体基因淀粉样疾病,目前主要作为心肌病,医生能够避免心脏衰竭肝脏和心脏移植;家族性淀粉样多神经病患者接受肝移植可以受益,因为肝脏的主要变异来源,疾病有关的竞技场队伍。90%的患者存活的移植,这种手术的基因治疗家族性淀粉样多神经病进展放缓,但并不能阻止它的野生型转体基因蛋白质可以继续形成淀粉样蛋白。
不及时治疗,amyloidoses竞技场队伍是不断进步和不可避免的死亡,大约十年的课程从最初的症状到死亡。
寻找治疗
凯利在1990年代中期,开始寻找TTR-amyloidogenesis-inhibitors和几年后开始关注TTR-binding化合物的一个家庭,所谓的苯并恶唑,其基本设计将进一步阐述了成tafamidis使用基于结构的药物设计范例。马萨诸塞州2003年,凯利与剑桥的一家生物技术公司,FoldRx制药(现在的辉瑞公司的全资子公司),这些化合物开发和优化其中一个成一个口头amyloidoses竞技场队伍的可用药物治疗。结果是tafamidis葡甲胺的临床前测试直到现在仍未公开。
凯利和他的同事设计tafamidis绑定到自然、功能结构(突变体和野生型),竞技场队伍,防止它偏离这种自然,功能形成淀粉样状态。竞技场队伍的自然,函数形式是“四聚物”由四个副本的蛋白质。淀粉样变发生在这些四聚体破碎和个人竞技场队伍蛋白质(“单体”)发生形状变化使他们能够misassemble功能失调的淀粉样蛋白聚集。包括在竞技场队伍总体分布是淀粉样fibrils-protein栈由数以百万计的竞技场队伍monomers-although研究者怀疑小,寿命比女人短pre-amyloid总量做更多直接损伤神经细胞和神经纤维。
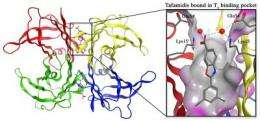
发病早期amyloidoses竞技场队伍是由遗传引起的突变削弱竞技场队伍四聚体的粘在一起的能力,生产单体更容易聚合成淀粉和其他聚合结构。幸运的是,四聚物竞技场队伍,这是备份的载体甲状腺激素通过血液中甲状腺素,有两个无人thyroxine-binding网站在其最长和最弱接缝。凯利和他的同事设计tafamidis抓住这两种thyroxine-binding网站,以一种桥梁接缝和帮助防止四聚物分开。
稳定的影响
新出版的分子和结构数据显示,tafamidis确实稳定竞技场队伍四聚体,血液中的正常生理条件下,甚至在异常条件下时,他们会更容易分解和重组为淀粉。Tafamidis有稳定影响正常“野生型”的四聚体蛋白质竞技场队伍以及那些由疾病有关的突变体和野生型单元竞技场队伍。
“有超过一百个竞技场队伍突变导致淀粉样变,但绝大多数的竞技场队伍能够被tafamidis绑定,在自然四聚物状态,”凯利说。
tafamidis-type化合物的整个开发过程,凯利和他的同事们与伊恩·a·威尔逊的斯克里普斯研究实验室,汉森的结构生物学教授,斯克里普斯研究Skaggs研究所的成员。威尔逊实验室专门使用x射线晶体学来确定的原子结构相互作用的蛋白质。每当生成小分子稳定器的竞技场队伍,提供有趣的生化稳定,威尔逊的团队分析了它的结构。”最后,我们有30多个小分子stabilizer-TTR结构决定的,为了生成tafamidis和识别的分子间的相互作用,导致自然四聚物竞技场队伍的稳定,”斯蒂芬·康纳利说,威尔逊实验室科学家谁执行这些结构研究,谁是合作者。
小分子苯并恶唑、tafamidis最终进入临床试验优化了几个标准,包括其能力稳定,四聚物的竞技场队伍薄弱的缝。“我们发现的一端tafamidis结构符合四聚物的疏水性thyroxine-binding口袋里,而另一端附近的极性氨基酸结合,两种类型的交互桥接或稳定四聚物的两半,”康奈利说。药物的稳定力大大降低了速度这些四聚体分开,这样大大降低了淀粉样蛋白的生成速率。
Tafamidis被认为是一种“孤儿”药物,因为它的最初目的治疗人口相对较小的人口多神经病。然而,即使是野生型形成淀粉样蛋白在10到20%的竞技场队伍日益增长的老年人population-leading心肌病。因此,这个条件,和tafamidis等药物治疗,可能是制药行业的日益增长的兴趣。