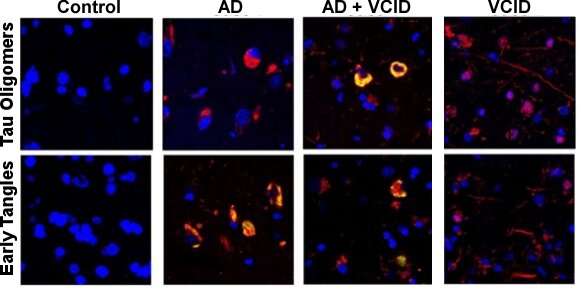
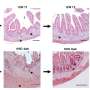
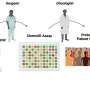
细胞毒性τ异构体(cis P-tau;与τ寡聚物(红色)部分与绿色;顶部)和τ缠结(绿色;底部)在阿尔茨海默病(AD)和混合广告和VCID大脑,但发现没有其他τ亚型VCID大脑。信贷:图像提供的博士出席Albayram南卡罗莱纳医科大学的。
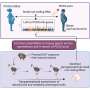
研究人员仍然困惑什么导致痴呆和如何对待和扭转患者的认知能力下降。在史无前例的一项研究中,南卡罗来纳医科大学的研究人员(音乐)和贝斯以色列女执事医疗中心(BIDMC),哈佛医学院发现cis P-tau,有毒,不能溶解的健康的大脑蛋白质,是血管性痴呆的早期标志(VaD)和阿尔茨海默病(AD)。他们的研究结果发表在6月2日科学转化医学定义分子机制,导致这种有毒蛋白的积累。此外,他们显示,这种有毒蛋白单克隆抗体(mAb),目标是能够预防疾病病理学和记忆丧失在广告和VaD-like临床前模型。另外,这种治疗甚至能够扭转认知障碍在一个广告的临床前模型。
“我们相信,我们的发现不仅发现了cis P-tau作为一种以前未被认识的主要的早期司机VaD和广告,还发现了一个非常有效的和特定的免疫疗法为治疗和预防目标这种常见的疾病司机广告和VaD早期阶段,“不知道Albayram说,博士,该研究心脏病和助理教授在医学系的音乐。
老化是一个正常的生活中,我们经历的一部分削弱我们的骨骼和肌肉,加强我们的血管和一些记忆缺失。但对于全世界约5000万人,这些记忆衰退变得越来越严重,最终导致痴呆的诊断。
痴呆是一个总括的术语,它包括广告,占60%,80%的病例;和监督,第二个最常见的原因;和其它不太常见的病态。目前,没有有效的治疗方法。有趣的是,大多数广告病例血管组件,表明更广泛的认知功能和健康的大脑血管之间的关系。更好的理解这种关系可以提供一个平台来发现新的治疗目标。
“我们的工作提供了证据表明独联体P-tau可能致病因素来解释和监督,这不是一般与其它痴呆,“添加至岑溪秋博士位联席作者BIDMC博士后研究员,哈佛医学院。
在临床前模型的VaD,年轻的老鼠脑部炎症和的迹象记忆丧失在一个月之内。然而,治疗这些老鼠与cis P-tau马伯阻止神经退化和认知能力下降到六个月。在一个单独的临床前模型的广告,老老鼠表现出严重的认知障碍。令人兴奋,这严重损害时显著逆转老鼠cis P-tau马伯。
“这些数据表明,独联体P-tau上游致病因素可能是早期常见的两种疾病,“Albayram说。
将获得的信息临床前模型人类通常是困难的,但这项研究提供了乐观的理由。独联体P-tau积累造成戏剧性的变化在影响细胞的基因结构和监督模式;这些变化是一致的与那些在人类AD患者。研究人员继续表明,治疗与cis P-tau马伯逆转85%到90%的这些变化表明这种潜在疗法的力量。
“基因组景观真的适应这种有毒蛋白质的沉默之后,“Albayram说。“这是一个巨大的发现。”
不仅是Albayram和邱兴奋这些发现,但在音乐的同事已经很热衷于这项工作。
“我可以继续下去,“说Adviye Ergul,医学博士博士,教授医学院病理学系和实验室医学音乐。“他们提供坚实的证据,有积累的一个特定形式的τprotein-cis P-tau-that凸显了不同τ蛋白病理学和监督研究。”
这个开创性的研究开启了一个新的潜在的免疫疗法,强调几个新领域的研究需要探索。虽然研究人员划定一个通路,导致cis P-tau的积累,潜在的血管异常之间的联系和激活途径的需要确定。更好的理解如何有毒cis P-tau与健康的反式P-tau交互可以提供进一步的洞察广告疾病的进展。
广告和VaD可能不是唯一受到高水平的cis P-tau疾病。其他脑部疾病与血管组件也可能源自这种有毒蛋白,但进一步的研究需要建立这种联系。
,“独联体P-tau可能是一个共同的致病因素潜在的创伤性脑损伤,通过广告,”邱说。
随着年龄的增长,我们的记忆开始lapse-misplacing车钥匙或忘记的名字acquaintance-we恐惧的可能性,这是第一个痴呆的迹象。虽然目前还没有批准治疗逆转痴呆的生理效应,这项新的研究可能提供希望新疗法是在拐角处。
更多信息:至岑溪邱et al,独联体P-tau构成血管对认知障碍和痴呆的贡献和免疫治疗可以有效地针对性的老鼠,科学转化医学(2021)。DOI: 10.1126 / scitranslmed.aaz7615
期刊信息:科学转化医学
所提供的南卡罗来纳医科大学的