两剂的安全性和免疫原性HPV-16/18 AS04佐剂的疫苗Cervarix
在《华尔街日报》最近的一项研究人类疫苗和免疫治疗显示,两剂HPV-16/18 AS04-adjuvanted疫苗Cervarix(葛兰素史克)非劣三剂在当前进度。
自高覆盖率和合规率很难实现与当前three-dose HPV vaccineregimen,几项研究已经看着减少剂量的数量的可能性。概念验证剂治疗计划可以提供足够的预防宫颈癌最初来自2011年在哥斯达黎加进行研究。自那时以来,一些国家已经考虑转向剂治疗计划或已经这么做了。欧盟委员会(European Commission)最近获得营销授权Cervarix剂治疗时间表9-14岁女孩,和欧盟以外的Cervarix剂治疗时间表批准在十多个国家,包括巴拿马、危地马拉、洪都拉斯、萨尔瓦多、海地、苏里南、智利、圭亚那、尼日利亚、加纳、巴基斯坦和孟加拉国。
随机,partially-blinded I / II期临床试验评估的免疫原性和安全性两个剂量的授权制定Cervarix(20µg hpv16 L1 HPV-18一种,每个人,20/20”)或另一个配方(40µg每个hpv 16和HPV-18种;在不同的年龄段,40/40”),相比之下,标准three-dose授权制定的时间表。健康的女性(年龄分层:9-14、15 - 19、20 - 25年)被随机分配接受两个剂量的疫苗在0和6个月,或者三个剂量的疫苗月0,1,6。
试验于2007年发起,由21中心在加拿大和德国。24个月的结果分析以前发表在HV&I,当前的研究提出了48个月的结果分析。剂治疗后40/40的配方没有好处,目前的研究集中在数据剂治疗制定9-14岁女孩和20/20标准three-dose 20/20安排在15 - 19岁妇女。
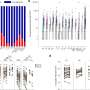
研究人员报告说,所有最初血清反应阴性的受试者有hpv 16和HPV-18抗体和血清反应阳性的48个月。hpv 16的动力学,-18、-31和-45年抗体反应两组的结果相似,hpv 16和-18年几何平均滴度抗体滴度显著高于自然感染。疫苗有两组临床可接受的安全性。总之,抗体反应剂治疗计划许可的疫苗配方9-14岁女孩与标准three-dose安排出现在15 - 19岁妇女第一次疫苗接种后长达四年之久。
这些结果表明,剂治疗的时间表应该赋予类似水平的预防HPV感染和随后的宫颈病变和癌症的发展作为当前three-dose时间表。剂治疗时间表显然会更方便医生和病人,并有助于降低相关成本。作者认为这些好处可以方便的实现HPV免疫程序在低收入国家,以及提高疫苗覆盖率相对较低和系列完成率中观察到一些发达国家。
“合规是人类乳头瘤病毒疫苗接种的主要挑战。这些数据增强剂治疗计划的价值和应该导致利用率疫苗,随之降低发病率和死亡率子宫颈癌博士说:“罗纳德·埃利斯,主编人类疫苗和免疫治疗。